CO2 из этиленгликоля, большой прорыв!
2024-08-02
В настоящее время этиленгликоль производится с помощью энергоемкого


Первый автор: Фан ЛэйПереписка: Ван Lei Связь: Национальный университет Сингапура
В настоящее время этиленгликоль производится с помощью энергоемкого двухступенчатого термокаталитического процесса, который приводит к большому количествуCO2Выбросы. ЧерезЭлектроокисление этилена на основе возобновляемых источников энергии Устойчивое производство этиленгликоляЭто желательно; однако прямое электрическое окисление этилена имеет неудовлетворительную селективность продукта, особенно при высокой производительности. Здесь авторы сообщают о каскадной стратегии эффективного и селективного производства чистых растворов этиленгликоля без детектируемых побочных продуктов в условиях окружающей среды. В частности, используя электрохимически полученную перекись водорода в качестве окислителя, в катализаторе/Твердые кислотные комплексы превращают этилен в этиленгликоль. Используя интегрированный реактор с твердым электролитом, автор в промышленно связанной плотности тока (100-500 мА см.-2) ПодЭто было достигнуто.60-70%Высокая эффективность использования электроники, Для производства этиленгликоля с полной селективностью продукта~ 100%). Далее автор связывает систему сCO2Электровосстановительный реактор интегрирован иДоказано использованиеCO2Устойчивое производство чистого этиленгликоля и воды в качестве единственного сырья.Статьи«Селективное производство этиленгликоля с высокой скоростью через каскадный катализ»Для названия,2023Год6Месяц26Опубликовано вПрирода КатализВ журнале.Контекст исследования1.Гликоль широко используется в качестве предшественника полиэфирного волокна, антифриза, хладагента и носителя энергии.2020Год, глобальныйПроизводство этиленгликоля превышает400010 тысяч тонн, Который, как ожидается, будет расти каждый год5-10%Перспективы применения широкие.2.В настоящее время этиленгликоль производится двухступенчатым методом с высоким энергопотреблением с большим количествомCO2Выбросы и другие потоки отходов. В этом способе этилен сначала получает кислород на катализаторе на основе серебраО2Окисление с образованием этиленоксида, который затем катализируется сильной кислотой для получения этиленгликоля. Из-за неизбежного чрезмерного окисления этилена на первой стадии,Общая селективность продукта этого метода ниже80%, Кроме того, несколько стадий разделения должны быть интегрированы в процесс, чтобы обеспечить конечный продукт, таким образомУвеличение затрат,3.Благодаря быстрому развитию производства электроэнергии из возобновляемых источников, производство электрифицированных химических веществ обеспечивает устойчивый путь к производству химических веществ в условиях окружающей среды.Недавно были исследованы электрокатализаторы на основе палладия для электрохимического окисления этилена до этиленгликоля в водном электролите, Повышенная селективность образования этиленгликоля наблюдается путем оптимизации энергии связи гидроксильных промежуточных соединений на поверхности палладия, несмотря на умеренную плотность тока~ 5 мА см.-2). При применении более высокого тока происходит незначительное перекисное окисление этилена и образование побочных продуктов (т. е.> 20%Сочетание селективных гликолевых альдегидов, ацетальдегидов, этиленоксида, муравьиной кислоты иCO2). В целом, в дополнение к используемым драгоценным металлам,Эти селективные проблемы по-прежнему препятствуют практическому внедрению прямого электрического окисления этилена в направлении устойчивого производства этиленгликоля.4.Чтобы обойти вышеупомянутые ограничения термического катализа и прямого электрохимического окисления этилена,Авторы разработали каскадный каталитический метод для достижения селективного производства растворов чистого этиленгликоля при промышленно значимых плотностях тока в условиях окружающей среды, Первая стадия каскадного процесса-электрокаталитический процесс, вторая стадия-термический (гетерофазный) каталитический процесс. Как показано на рисунке. На рисунке1сВо-первых, было построено, способное производить отделение от любого ионного электролитаH2О2Чистый поток раствора в электрохимический реактор. Реактор восстановлен путем использования двухэлектронной реакции восстановления кислорода2е-ОРР), Демонстрируя высокую эффективность Фарадея (ФЕ) (> 90%) И регулируемая плотность тока. По сравнению с энергоемким антрахиноновым процессом, эта стратегия продемонстрировала преимущества низкого энергопотребления, модульности и производства по требованию, что позволяет избежатьH2О2Спрос на хранение и транспортировку. В последующих реакторах авторы использовали негогенные катализаторы (титаново-кремниевые молекулярные сита)-1(TS-1)) И твёрдые кислоты (сульфированные полистиролы)-Комбинация дивинилбензола), на которой может быть около100%Селективность продукта непосредственно в виде чистого потока образует этиленгликоль.Конструкция автора успешно развязывает окисление этилена и электродный потенциал, тем самым не только избегая неизбежного перекисного окисления этилена, но и упрощая конструкцию реактора и разделение продуктов вниз по течению/Очистка. Достижение высокой эффективности электронного этиленгликоляЭТЕ;Методы) в промышленности, связанные с плотностью тока100-500 мА см.-2Для производства этиленгликоля60-70%Выход и обеспечивает до5,31 ммоль ч-1Высокая скорость производства этиленгликоля. Авторы далее связывают систему с электрохимиейCO2Реактор восстановления соединен для достижения отCO2Производство этиленгликоля. На основе предварительного технико-экономического анализа,Авторы доказали, что их стратегия может обеспечить устойчивое производство этиленгликоля с хорошей экономической осуществимостью и отрицательными выбросами углекислого газа.
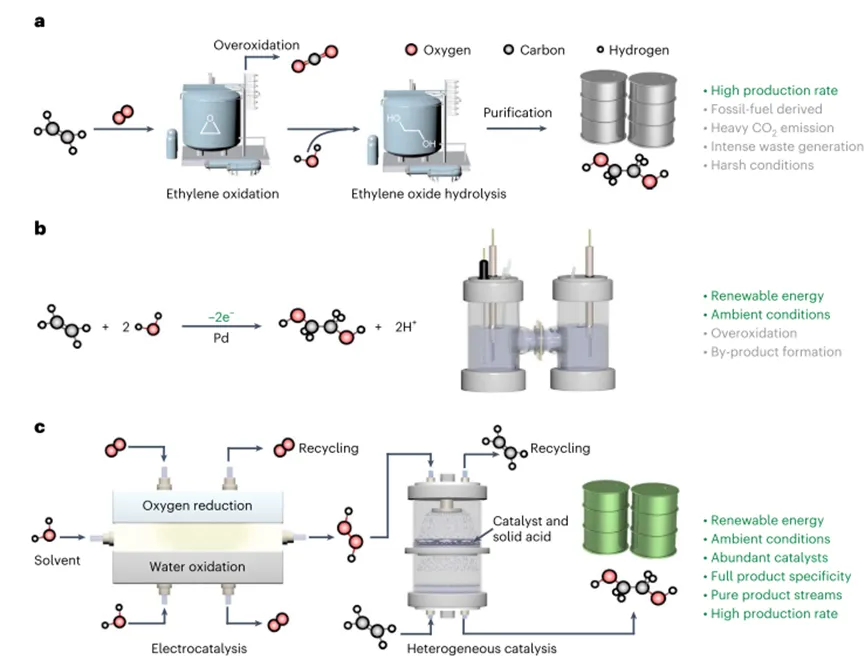
Рисунок1Сравнение схематических путей производства этиленгликоля
Презентация результатов
Разъединение окисления этилена посредством каскада каталитического соединения
Контроль электрохимических реакций с участием углерода (например, прямое электрическое окисление этилена и электрохимияCO2Основная проблема селективности восстановления обусловлена многофункциональными связывающими свойствами атомов углерода, Таким образом, эти реакции обычно включают сложные сети реакций/Промежуточный, его противоэлектрод-Химическое состояние, состав, мелкие грани и морфологические изменения на границе раздела электролита, а также потенциал противоэлектрода, локальныйРНИ качество передачи очень чувствительны. Таким образом, обычно трудно контролировать селективность этих реакций и получать желаемый продукт с высоким выходом. Таким образом, предотвращение нежелательного перекисного окисления этилена и образования побочных продуктов является сложной задачей, особенно когда избыточный потенциал повышается для достижения высоких скоростей производства. Чтобы решить эту проблему,Стратегия авторов состоит в том, чтобы отделить стадию окисления этилена от поверхности высокоэнергетического электрода, в то же время используя электрохимически произведенные окислительные реагенты для окисления этилена.Автор сначала определяетH2О2Как хороший кандидат, цель автора, с точки зрения энергии и окружающей среды. В частности,H2О2Имеет достаточные стандартные восстановительные потенциалы для окисления этилена и может пройти через2е-ОРРЭлектрохимически получается. Авторы измерили различные плотности токаETEИ производительность. В10 мА см.-2Когда самый большой этиленгликольETEОк.66%ИETEНебольшое снижение с увеличением плотности приложенного тока, возможно, из-заH2О2Накопление при высокой плотности тока приводит к поверхности электродаH2О2Чрезмерное восстановление вH2О, С другой стороны, скорость производства этиленгликоля сначала увеличивается с плотностью тока и в30 мА см.-2При максимальном уровне0,23 ммоль ч-1А затем даже выше50 мА см.-2Плотность тока немного уменьшается. Снижение скорости производства этиленгликоля при высокой плотности тока может быть связано сH2О2Электрохимическое разложение при высоком надпотенциале.
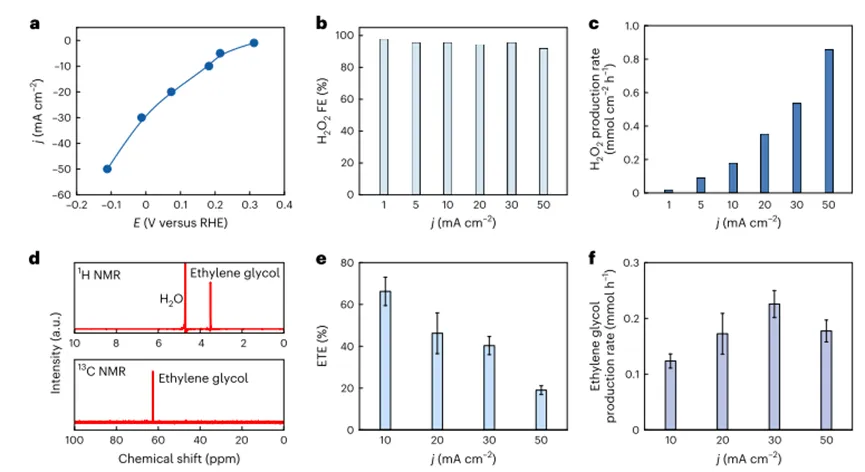
Рисунок2Производство этиленгликоля с помощью каскадного катализа
Важность использования кислого электролита
Ранее наблюдалось, что этиленоксид являетсяTS-1Основной продукт каталитического окисления этилена, и требуется дополнительная стадия гидролиза для получения этиленгликоля в качестве основного конечного продукта. Чтобы справиться с этой задачей, авторы провели предварительные испытания перед каскадным катализом, который будетTS-1Добавлен к непрерывной продувке этилена1000 ппм х2О2В растворе. Реакция1Через час автор сдает1H ЯМРПолученный раствор измеряли и наблюдали смесь этиленоксида и этиленгликоля.Производственное соотношение этиленгликоля и этиленоксида достигает1:2,5, Предыдущая работа уже показала, чтоTS-1Каталитический этилен черезH2О2Окисление, сначала черезС = СЭпоксидирование связи образует этиленоксид, а затем этиленоксид вTS-1Кислотные сайты (включая кислотные формыTi-OOHГидратируется с сайтом Льюисовой кислоты каркасного титана, чтобы получить конечный продукт этиленгликоль.Поэтому авторы предполагают, что кислотные условия могут быть благоприятными вTS-1На этом образуются гликоль. Чтобы проверить это, авторы затем добавили в вышеуказанный раствор0,1 м х2ТАК4Для повышения селективности этиленгликоля. Результаты оказались положительными; этиленгликоль1 ХЯМРЗначительно увеличивается интенсивность пика за счет исчезновения пика этиленоксида. Основываясь на этих наблюдениях, авторы будутH2ТАК4Электролиты вводят для повышения общей селективности по отношению к этиленгликолю. В результате гликоль является единственным продуктом, наблюдаемым в системе автора. Другими словами, достигается полная специфичность продукта для прямого окисления этилена до этиленгликоля, что, по-видимому, не было достигнуто ранее.

Рисунок3Исследование механизма каскадных каталитических систем
H2О2Динамическое соответствие производства и использования
Так как вВысокая специфичность продукта этиленгликоля в системе автора, общее количество конечного продуктаETEПоH2О2ФормированиеФЕИH2О2Решение об эффективности использования, Хотя.H2О2-Что?ФЕПри всех плотностях тока он остается высоким90%), Но общий эрт ниже и уменьшается по мере увеличения общей плотности тока.H2О2FEИETEЭто несоответствие между может быть связано сTS-1Ограниченная каталитическая активность в отношении окисления этилена, или другиеH2О2Существование пути разложения. Что касается второго реактора, когда автор просто поместил твердый электролитH2О2Когда производственный реактор интегрирован с реактором окисления этилена, основным продуктом является этиленоксид, а не этиленгликоль, подобно тому, как ранее наблюдали авторы. Потому что автор используется для чистогоH2О2Производство твердых электролитов (сульфированный полистирол-Дивинилбензол) также высококислый, авторы предполагают, что тот же твердый электролит также может способствовать прямому образованию этиленгликоля, аналогичноH2ТАК4Функции.Таким образом, авторы напрямую связывают твердый кислотный электролит сTS-1Смешайте и поместите эту твердую кислоту/Композит катализатора вводят в реактор окисления этилена. Как и ожидалось, поток чистого этиленгликоля был успешно получен каскадным катализом.В оптимизированных условиях, при всех испытаниях плотности тока10-200 мА см.-2) Под,ETEМожет достигать ок.70%, Скорость образования этиленгликоля увеличивается с увеличением плотности тока, максимум2,4 ммоль ч-1В электролизе1Через час получить ок.0,08 мКонцентрация конечного продукта (рис.4 e). Кроме того, скорость производства этиленгликоля иH2О2Скорость производства увеличивается пропорционально, а наклон0,75Как показано на рисунке4FПоказано, что75%Электрохимическое производствоH2О2Используется для получения этиленгликоля. ОтсутствуетH2О2Может быть, поTS-1В результате индуцированного разложения авторы считают, что этого можно в значительной степени избежать, разработав катализаторы с кинетикой, благоприятной для окисления этилена.
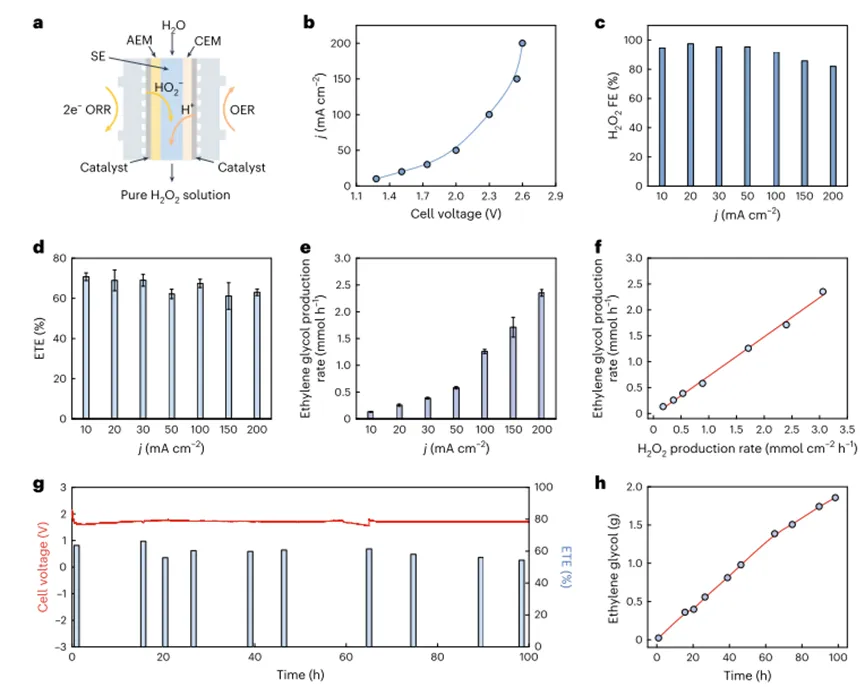
Рисунок4Каскадное производство чистого раствора этиленгликоля
Повышение производительности этиленгликоля
Для дальнейшего улучшения каталитических свойств авторы провели скрининг нескольких основанных на различных функциональных группCNTМатериалы и функционализировать аминныеCNT(Камера Cnt-hr 2Идентифицирован как используемый в реакторе твердого электролита автораH2О2Наиболее эффективные электрокатализаторы производятся. В типичных условияхКамера Cnt-hr 2В2.05 VОтносительно низкое напряжение батареиH2О2Производственное обеспечение500 мА см.-2Высокая плотность тока (рис.5а). Максимальная скорость производства этиленгликоля достигнута5,3 ммоль ч-1(Рисунок5 б,С), Когда применяется дляH2О2Производство500 мА см.-2При высокой плотности тока. В связи с сохранениемH2О2Селективность образования и последующего производства этиленгликоля, общая эффективность использования электронов производства этиленгликоля остается на уровне> 60%Высокий уровень. Кроме того,Авторы достигли высокой плотности тока200 мА см.-2) Непрерывное производство потока чистого этиленгликоля превышает24Часов и имеет довольно стабильныйETEИ напряжение батареи (рис.5d), Путем масштабирования электрохимического реактора до4 см2И уменьшить скорость потока воды, автор можетПроизводит высокие концентрации раствора этиленгликоля, до0,5 м(Рисунок5е) 。В целом, авторУспешно доказано, что поток чистого этиленгликоля может быть произведен с использованием каскадной системы с фактической производительностью, И авторы считают, что расширение авторской системы возможно благодаря ее простому и эффективному дизайну.
Окисление этилена на катоде и аноде
Чтобы продемонстрировать адаптивность авторской системы, автор спроектировал и интегрировал трехкамерный реактор и реализовал окисление этилена одновременно на аноде и катоде. Как показано на рисунке. Как показано5FКак показано, независимое производство этиленгликоля и этиленоксида было достигнуто с обеих сторон электрического реактора.Эффективность использования электронов при производстве этиленгликоля и этиленоксида достигается одновременно при всех приложенных плотностях тока60-70%(100-300 мА см.-2Как показано на рисунке1бПоказано). Соответствующее напряжение батареи в дополнительной диаграмме5 г) 。Детальное обсуждение и техник-экономический анализ конструкции этого интегрированного реактора дополнительно подтверждают перспективный потенциал каскадной стратегии авторов для производства этиленгликоля.
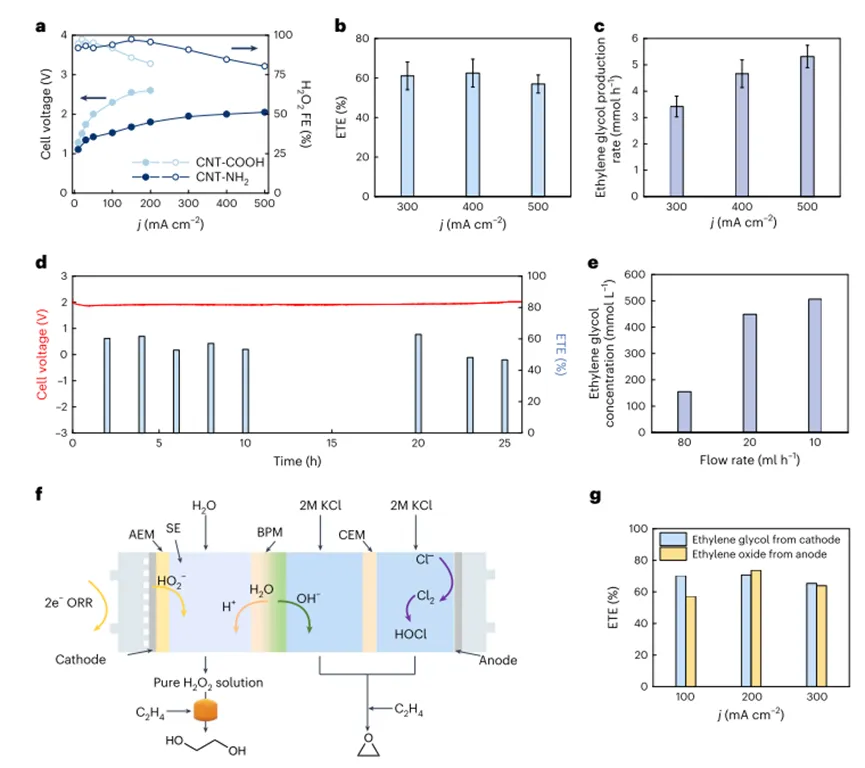
Рисунок5Оптимизация катализаторов и систем для более практического применения
ПоCO2Производство этиленгликоля
На рисунке6аВ, автор впервые прошел на основе твердого электролитаCO2Электровосстановительный реактор производит этилен, а затем полученный этилен подают в вышеупомянутый каскадный реактор для производства этиленгликоля.ДляCO2Электрическое восстановление, с использованиемCu2ОНанокуб (100 нмВ качестве предшественника катализатора. В200 мА см.-2Максимальный этиленФЕДля48%, Другие жидкие продукты, в том числе этанол, уксусная кислота, муравьиная кислота и н-пропанол, в то же время в целомФЕБлизко28%,Для достижения соответствующей производительности этилена авторы используют размеры для4 см2Катод для поддержания800 мА(200 мА см.-2(Г-н Гао)CO2Восстанавливает ток. Затем автор будет экспортировать газCO2,С2H4,COИH2Смесь) подают непосредственно в реактор окисления этилена без очистки. В100 мА(1 см2,100 мА см.-2Ниже, скорость производства этиленгликоля только0,2 ммоль ч-1Соответствует12%-Что?ETE, НеудовлетворительноETEЭто может быть связано с низкой концентрацией этилена в газовой смеси на выходе. Чтобы проверить это, автор затем вводит концентрациюКохРаствор для удаления избытка в газовой смесиCO2В результате концентрация этилена может быть значительно увеличена. Как и ожидалось,Скорость производства этиленгликоля увеличилась до примерно0,5 ммоль ч-1И для производства этиленгликоля, соответственноETEТакже удвоить, Таким образом, авторы считают, что дальнейшая оптимизация кинетического соответствия между производством этилена и окислением может привести кCO2Еще более высокая общая эффективность тока при производстве этиленгликоля.
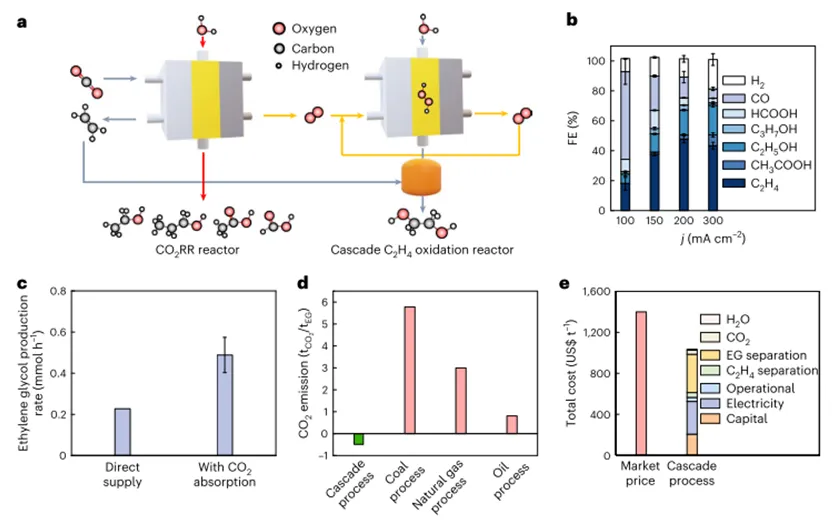
Рисунок6ИзCO2Каскад производства этиленгликоля
Резюме полного текста
Разработана каскадная каталитическая система, Участвующего в электрокатализе, а затем термическом катализе производства этиленгликоля. Интегрированная система показала полную селективность продукта в мягких условиях.С использованием электрохимииH2О2Как окислитель и богатый силикат титана в качестве катализатора, высокая общаяETE-Что?~ 70%Реализовано производство этиленгликоля.Во-первых, когда с твердыми электролитами на основеH2О2При создании реакторов в сочетании, авторы остаются высокимиETEВ то же время достигается практическая плотность тока (т. е.500 мА см.-2Производство этиленгликоля.Во-вторых, благодаря комбинации катализатора и твердой кислоты получают чистый поток этиленгликоля, который способствует отделению продуктов ниже по потоку./Очистка, Наконец,Каскадные системы показали, что Gundam100Час непрерывного производства гликоля для превосходной долговечности, Автор также разработал использованиеCO2Интегрированная система производства этиленгликоля, которая заменяет этилен, полученный из ископаемого топлива, в качестве сырья, и успешно реализована0,5 ммоль ч-1Скорость производства этиленгликоля. Предварительная технико-экономическая оценка показывает, что в процессе производства этиленгликоля, приводимого в движение возобновляемой электроэнергией по цене, которая в настоящее время достижима, перспективная экономическая жизнеспособность дает ссылку на окисление метана, окисление спирта и эпоксидирование.

Сопутствующая информация

Контакты нас.
Веб-сайт: www.amoycat.cn
Адрес: 66 Xinyuan South Road, район Хайцан, Сямынь

Общественный номер QR-код






