Science: адипиновая кислота, революционный прорыв!
2024-08-02
Нейлон является первым синтетическим волокном, появившимся в мире и принадлежащим к полиамидным волокнам (нейлону). Его синтез является не только крупным прорывом в индустрии синтеза волокон, но и очень важной вехой в химии полимолекул. Нейлон можно увидеть повсюду в современной жизни, особенно в текстильной промышленности, где мы носим одежду, электрооборудование, машины и оборудование.

Нейлон-первое синтетическое волокно, появившее в мире, которое относится к полиамидным волокнам(Нейлон), его синтез является не только крупным прорывом в индустрии синтеза волокон, но и очень важной вехой в химии полимеров. Нейлон можно увидеть повсюду в современной жизни, особенно в текстильной промышленности, где мы носим одежду, электрооборудование, машины и оборудование.
В настоящее время нейлон 66 в основном использует процесс конденсации адипиновой и адипиновой кислот, в то время как адипиновая кислота в основном производится путем окисления циклогексанона/циклогексанола азотной кислотой с годовым выходом в миллионы тонн. Однако этот процесс требует использования большого количества агрессивных сильных кислот, и он производит большое количество NO, NO2,Н2O и другие газы, особенно парниковые газы N2O, одним из основных источников выбросов является процесс производства адипиновой кислоты. Кроме того, диэфир адипиновой кислоты широко используется в производстве пластификаторов, парфюмерии, смазочных масел, растворителей, активных фармацевтических ингредиентов и нейлона. Существующий процесс синтеза адипиновой кислоты был зрелым еще в 1940-х годах. В течение почти 80 лет ученые исследовали новые методы и новые процессы синтеза адипиновой кислоты. 20 декабря 2019 годаАльберт, Германия-Профессор Маттиас Беллер из Университета Эйнштейна и его сотрудникиВScience опубликовала статью, в которой сообщается о совершенно новом процессе производства адипиновой кислоты без необходимости в азотной кислоте. Они использовали одноступенчатую каталитическую систему палладия для получения одноступенчатого дикарбонилирования бутадиена для получения адипиновой кислоты, которая обладает высокой активностью, высокой селективностью и универсальностью, решая проблемы, с которыми на протяжении десятилетий сталкиваются научные и промышленные круги. Томас Шауб из Лаборатории каталитических исследований Гейдельбергского университета-BASF, Германия, написал обзорную статью и обобщил последние достижения и перспективы синтеза адипиновой кислоты за последние годы. (PS: Я чувствую, что BASF скоро начнет с этого патента или уже начал)
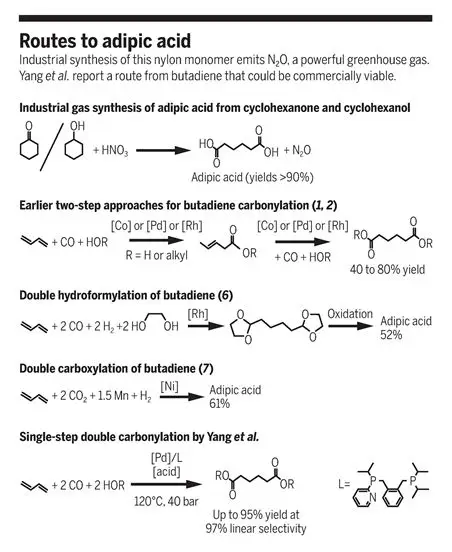
ИзГоворя о прямом карбонилировании 1,3-бутадиена
Реакция карбонилирования является одним из наиболее важных применений промышленного катализа, с более чем ежегодным производством10 миллионов тонн различных карбонильных соединений (альдегидов, кислот и сложных эфиров). Хотя исследователи впервые обнаружили процесс карбонилирования, катализируемый гомогенной фазой, почти 80 лет назад, все еще существует несколько нереализованных целей, наиболее значимыми из которых, вероятно, являются прямое дикарбонилирование 1,3-бутадиена. Реакция дикарбонилирования бутадиена сделает возможным экологически чистое и экономически эффективное производство адипента. адипинат является важным мономером для синтеза полиамидов и сложных полиэфиров. Реакция дикарбонилирования бутадиена с образованием адипиновой кислоты и ее сложных эфиров может стать новой альтернативой, позволяющей избежать использования азотной кислоты и парниковых газов N2Выбросы O и селективность сырья более гибкая. Однако селективное дикарбонилирование бутадиена для получения адипиновой кислоты и ее производных также очень сложно, поскольку оно требует двух последовательных и неселективных карбонилирования для получения целевого продукта с пентеновой кислотой в качестве промежуточного соединения. В более ранних исследованиях реакция должна была протекать в два этапа: реакция карбонилирования бутадиена с образованием 3-глутаровой кислоты, а затем реакция карбонилирования 3-глутаровой кислоты с использованием гоунфинированного кобальтового, палладдиевого или родиевого катализатора с образованием адипиновой кислоты. Условия и катализатор обеих стадий требуют тщательного выбора, так как существует множество потенциально нежелательных побочных продуктов, таких как изомеры или полимеры. Отдельно оптимизированные реакции несовместимы и не могут быть превращены в высокоэффективную одноэтапную реакцию. В течение десятилетий многие компании, в том числе BASF, DuPont, Shell, Dow, Kularet и Sinopec, изучали возможность получения адипината посредством реакции дикарбонилирования бутадиена. В то время как исследователи изучали различные системы реакций в лаборатории, их индустриальные процессы сталкиваются с проблемами недостаточной активности, недостаточной селективности или и того, и другого.
Как это сложно?
В последние годы произошли новые разработки в способе двуфункционального получения адипиновой кислоты бутадиена.Mormul et al. сообщили, что в присутствии этанола родий катализирует дигидроформилирование с образованием защищенного ацетальдегидом гексадегидного промежуточного соединения, которое может быть окислено до адипиновой кислоты. Общий выход адипиновой кислоты на основе бутадиена после окисления составляет 52%. Хотя на стадии гидроформилирования достигается двуфункциональное превращение линейного промежуточного соединения, его экономическая жизнеспособность недостаточно высока и требует дальнейшего совершенствования. Tortajada и др. Недавно сообщили о реакции бискарбоксилирования бутадиена с диоксидом углерода с использованием никелевого катализатора, которая проводится с ненасыщенной дикислотой в качестве промежуточного продукта, а затем гидрирование с использованием того же катализатора, поскольку в качестве сырья используется диоксид углерода, а в качестве катализатора используется металл с богатыми запасами, но выход адипиновой кислоты составляет всего 61%. Первая стадия требует добавления марганца в качестве вспомогательного реагента, что препятствует применению этой системы в массовом химическом производстве. Другими словами, прямое карбонилирование 1,3-бутадиена обеспечивает более экономичный и экологически безопасный способ получения производных адипиновой кислоты, имеющих важное значение в промышленности. Однако из-за сложной реакционной сети региоизомерного карбонилирования и изомеризации практически не было найдено высокоселективного практического катализатора.

Новый прорыв
В связи с этим, Альберт.-Профессор Маттиас Беллер из Эйнштейновского университета и др. приняли конструкцию пиридинилзамещенного бисентосфонового лиганда, который в сочетании с палладием катализирует 1,3-бутадиен, монооксид углерода и бутанол с образованием адипиновой кислоты с выходом ≥ 95%, селективностью 97% и атомной экономией 100%. Эта одностадийная каталитическая система в качестве альтернативы синтезу адипиновой кислоты и ее сложного эфира обладает высокой активностью и селективностью при добавлении монооксида углерода к каждому концу бутадиена с использованием палладиевого катализатора без образования побочных продуктов. Катализатор также может быть использован для катализа превращения 1,2-бутадиена в различные другие сложные и триатные эфиры.
Основные моментыРеакционная сеть с использованием 1,3-бутадиена для синтеза адипината
Селективное дикарбонилирование бутадиена в гексакарбоновую кислоту и ее производные требуют двух последовательных и неселективных карбонилирования для достижения целевого продукта с пентеновой кислотой в качестве промежуточного соединения. Как показано ниже, этот каталитический процесс имеет несколько проблем:(I) катализатор должен способствовать двум различным реакциям карбонилирования на пластине на основе диена (что ранее не было достигнуто);(ii) продукт линейного дикарбонилирования должен быть селективно образован, хотя изомеризация первоначально образованного промежуточного монокарбонилирования до конечного олефина является особенно неблагоприятной с точки зрения термодинамики;(iii) необходимо ингибировать другие побочные реакции, такие как теломеризация, гидроалкоксилирование и сополимеризация.
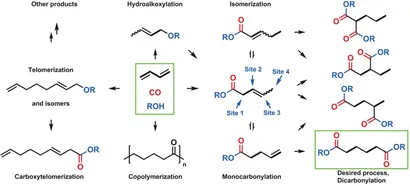
Рисунок1 Реакционная сеть с использованием 1,3-бутадиена для синтеза адипината
Основные моменты2. Оптимизация лиганда для палладия, катализирующего дикарбонилирование 1,3-бутадиена
Модифицированный с помощью основанияПроизводные 1,2-бис [(ди-бутилфосфин) метил] бензольного лиганда (L1,dtbpx) для достижения селективного дикарбонилирования 1,3-бутадиена для использования в серийном производстве метилметакрилата. Предварительные исследования по оптимизации этого лиганда показали, что получение линейного дибутиламина 4а с п-толуолсульфоновой кислотой в качестве вспомогательного катализатора при 120 ° С и 40 бар СО было менее активным, но более селективным. Производные dtbpx L2 и L3 были испытаны для улучшения характеристик катализатора. Однако увеличения активности не наблюдалось. Таким образом, добавление подходящих оснований к этому конкретному лиганду должно повысить активность соответствующей палладиевой каталитической системы в реакции алкоксикарбонилирования. Фактически, использование L4 значительно увеличило активность и выход диэфира (77%) за счет недостаточной селективности (48%). Принимая во внимание подходящую реакционную способность L4 и подходящую селективность L1, был разработан лиганд L5 (HeMaRaphos). Реакция дикарбонилирования 1,3-бутадиена проводится в присутствии HeMaRaphos и Pd(II) трифторуксусной кислоты [Pd(TFA)2] с выходом 85% диэфира адипиновой кислоты и линейной селективностью 97%.
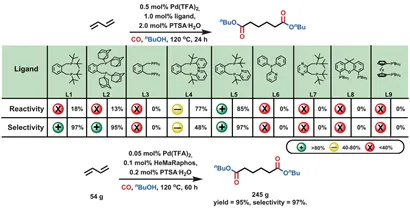
Рисунок2 Оптимизация лиганда для палладия, катализирующего дикарбонилирование 1,3-бутадиена
Основные моменты3. Дикарбонилирование 1,2-и 1,3-диена, катализируемое палладием
Чтобы понятьВлияние HeMaRaphos на производительность палладиевого катализатора, команда провела эксперименты по динамическому мониторингу. Первые полчаса, в Pd(TFA)2,Образование активного гидрида палладия наблюдалось in situ в смеси L5 и п-толуолсульфоновой кислоты (PTSA). Затем проводят реакцию алкоксикарбонилирования и селективно конъюгируют н-бутил-3-еновую кислоту н-бутиловый эфир 3а. Промежуточное соединение непрерывно накапливается через 90 минут, достигая максимального выхода около 50%. В это время реакция останавливается, и 3а может быть отделен от реакционной смеси, в то время как активный катализатор также способствует изомеризации олефинов. Из-за его быстрого превращения в линейный диэфир адипиновой кислоты концевой олефин н-бутилпен-4-еновой кислоты 3c не был обнаружен. Во-вторых, были проведены подробные исследования по оптимизации влияния предшественника палладия, кислоты, температуры и давления, что еще больше повышает практичность процесса. Выход целевого продукта сложного эфира составляет 88 ~ 95%, линейная селективность 97%. Например, в отсутствие дополнительного растворителя реакцию можно проводить в диапазоне> 200-г, при этом нагрузка Pd составляет всего 0,05 мол. %. Помимо особой важности дикарбонилирования 1,3-бутадиена в химической промышленности, этот метод также обеспечивает решение для стабилизации цен на другие диены в тонком химическом производстве. Чтобы продемонстрировать универсальность каталитической системы, команда использовала 15 различных диенов и более 30 спиртов для синтеза соответствующих сложных диэфиров с высокой селективностью и выходом. Например, несколько линейных сопряженных диенов 1a-1f демонстрируют хорошую реакционную активность и региоселективность. Даже для внутренней сопряженной двойной связи (1f) реакция изомеризации преимущественно дает конечный продукт.
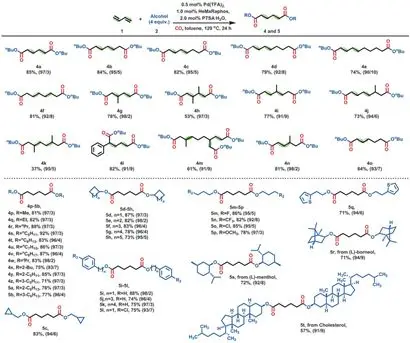
Рисунок3 Дикарбонилирование 1,2-и 1,3-диена, катализируемое палладием
Будущее можно ожидать
В этой работе предлагается альтернативный путь получения экономичной и экологически чистой адипиновой кислоты и ее сложных эфиров Одноступенчатая палладиевая каталитическая система для дикарбонилирования бутадиена до эфира адипинового эфира, при которой палладиевый катализатор добавляет к каждому концу бутадиена монооксид углерода без побочных продуктов, обладает высокой активностью и селективностью. Эта стратегия имеет большие перспективы для технологического применения, но перед практическим применением необходимо решить такие проблемы, как улучшение долгосрочной стабильности катализатора, поиск более простых и эффективных лигандов, нагрузка катализатора и извлечение благородных металлов.
Ссылки:
- Цзи Ян, Цзяван Лю, ХелфридНойманн, Роберт Франке, Ральф Джекстелл, Маттиас Беллер. Прямой синтез сложных эфиров адипиновой кислоты посредством палладий-катализируемого карбонилирования 1,3-диенов. Наука, 2019.DOI: 10,1126/science.aaz1293https:// doi.org/10.1126/science.aaz1293
- Томас Шауб. Производство адипиновой кислоты без закиси азота. Наука, 2019.DOI: 10,1126/science.aaz6459https:// doi.org/10.1126/science.aaz6459

Следующая статья
Сопутствующая информация

Контакты нас.
Веб-сайт: www.amoycat.cn
Адрес: 66 Xinyuan South Road, район Хайцан, Сямынь

Общественный номер QR-код






